2022年2月10日,我校动物科技学院孙少琛教授课题组在国际著名学术期刊Development在线发表了题为“Kinesin motor KIFC1 is required for tubulin acetylation and actin-dependent spindle migration in mouse oocyte meiosis”的研究论文,与2月11日在线发表的Science期刊论文“Mechanism of spindle pole organization and instability in human oocytes”同时报道了Kinesin家族蛋白KIFC1在卵母细胞成熟过程中的重要功能。

哺乳动物卵母细胞成熟质量关系到后续的成功受精及早期胚胎发育,是影响动物繁殖力的重要因素。卵母细胞减数分裂成熟是一个复杂的生物学过程,涉及到细胞周期控制、微管介导的纺锤体组装与染色体分离、细胞器重分布、微丝骨架介导的纺锤体迁移以及胞质分裂等。因此,深入研究卵母细胞成熟的分子调控机理,有利于拓展卵子质量控制的认识,为卵子质量改善提供理论基础。
驱动蛋白kinesin超家族是重要一类进化保守的马达蛋白,由ATP水解能量提供动力与微管结合,通过可变的尾部结合域和头部运动域将货物蛋白运输到特定位置发挥作用,kinesin家族是物质转运和细胞形态维持所必需的,在有丝分裂和减数分裂过程中被报道广泛参与微管动力学、染色体分离和细胞周期进程。KIFC1属于Kinesin 14亚家族,在有丝分裂过程中能够沿微管负端运动调控DNA的合成和运输,并参与微管的交联和运输。
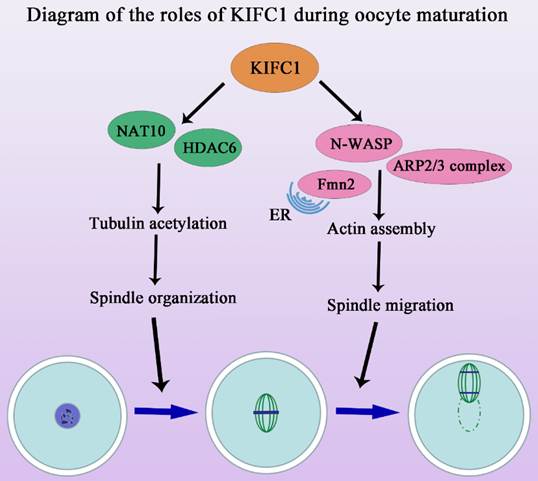
该研究发现,与有丝分裂中的作用不同的是,KIFC1除了参与减数分裂纺锤体组装外,其对卵母细胞成熟过程中的肌动蛋白动力学也至关重要。该研究采用活性抑制、敲低及外源mRNA挽救的手段,发现KIFC1不影响卵母细胞减数分裂恢复,但对于极体的排出至关重要。进一步分析发现KIFC1对于纺锤体形态的维持以及染色体的排列是必须的,且这一作用并不依赖于经典的MAPK信号通路。通过质谱分析预测及免疫共沉淀验证,发现KIFC1可能与HDAC6及NAT10等乙酰化及去乙酰化酶结合,通过运输相关蛋白影响微管的乙酰化水平参与了纺锤体的稳定性。此外,除了KIFC1传统的微管相关功能,该研究还发现KIFC1的缺失能够影响微丝的组装和纺锤体的迁移。研究结果显示KIFC1与微丝切割蛋白、结合蛋白等没有结合作用,但与两类关键的微丝成核蛋白Formin家族和Arp2/3复合物直接相关,从而影响胞质微丝的分布及皮层微丝的富集。
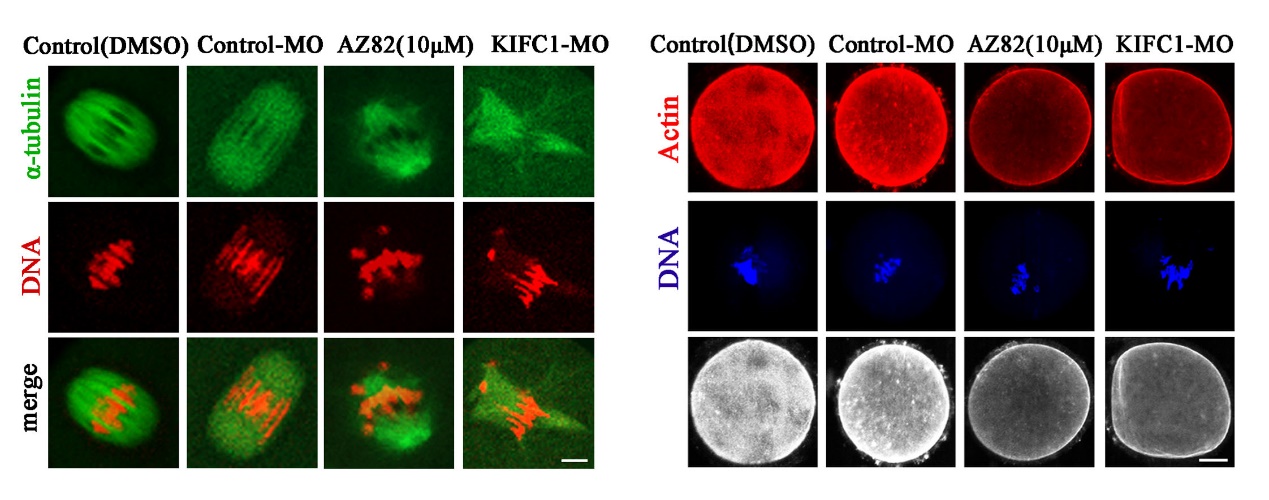
该研究不仅报道了KIFC1对减数分裂纺锤体形成的作用及分子机制,而且发现了KIFC1在卵母细胞成熟过程中参与微丝骨架调节的新功能。继课题组前期证明Rab23通过kinesin KIF17调控卵母细胞微丝动力学变化以来(Wang HH et al. Development, 2019),该系列工作拓展了在卵母细胞成熟过程中作为微管相关及依赖性的驱动蛋白kinesin家族参与微丝骨架调节的新认识。
同时在Science期刊发表的论文(So C et al. Science. 375:eabj3944. 2022 Feb 11)显示KIFC1在牛、猪、小鼠卵母细胞中稳定表达,但在人卵母细胞中缺失。该研究同样发现KIFC1在非人哺乳动物卵母细胞中敲低引起纺锤体的不稳定性,并导致染色体分离紊乱产生非整倍体;而外源KIFC1补充能够挽救人卵母细胞纺锤体的不稳定。该研究表明人卵母细胞缺乏KIFC1可能是纺锤体不稳定、引起非整倍性卵子并造成生殖障碍的一个原因。
动物科技学院硕士生单蒙蒙为该研究的第一作者,孙少琛教授为通讯作者,博士生邹媛婧, 潘振楠,鞠佳倩和硕士生张浩琳也参与了该项研究。该研究得到了国家重点研发计划及国家自然科学基金的资助。
全文链接:https://doi.org/10.1242/dev.200231